رسوب در شیمی: تعریف، مثالها و کاربردهای کلیدی
در دنیای شیمی، رسوب به تشکیل یک ترکیب نامحلول گفته میشود. این فرآیند میتواند از طریق واکنش بین دو نمک یا تغییر دما برای تحت تاثیر قرار دادن حلالیت یک ترکیب خاص رخ دهد. در واقع، خود ماده جامدی که در نتیجه این واکنش رسوبی شکل میگیرد نیز رسوب نامیده میشود.
تشکیل رسوب اغلب نشاندهنده وقوع یک واکنش شیمیایی است. با این حال، رسوب میتواند زمانی نیز رخ دهد که غلظت یک ماده حلشده از میزان حلالیت آن فراتر رود. پیش از تشکیل رسوب، رویدادی به نام هستهزایی رخ میدهد. در این مرحله، ذرات کوچک نامحلول با یکدیگر تجمع یافته یا با سطحی مانند دیواره ظرف یا یک بلور بذر پیوند برقرار میکنند.
نکات کلیدی درباره تعریف رسوب در شیمی
- در شیمی، "رسوب" هم به عنوان فعل و هم به عنوان اسم به کار میرود.
- رسوب کردن به معنای تشکیل یک ترکیب نامحلول است که میتواند از طریق کاهش حلالیت یک ترکیب یا واکنش بین دو محلول نمک ایجاد شود.
- ماده جامدی که از طریق یک واکنش رسوبی تشکیل میشود، رسوب نامیده میشود.
- واکنشهای رسوبی کاربردهای مهمی دارند. از آنها برای خالصسازی، حذف یا بازیابی نمکها، تولید رنگدانهها و شناسایی مواد در تجزیه و تحلیل کیفی استفاده میشود. در واقع این واکنش ها باعث تغییر حلالیت ماده مورد نظر ما میشوند.
به طور خلاصه، رسوب فرآیندی کلیدی در شیمی است که نقش مهمی در بسیاری از کاربردهای علمی و صنعتی ایفا میکند و حلالیت ترکیبات را تغییر میدهد.
رسوب در برابر رسوبدهنده: درک تفاوتها
ممکن است اصطلاحات مربوط به رسوب کمی گیجکننده به نظر برسند. در اینجا تفاوتها را به طور واضح شرح میدهیم:
- رسوبگذاری (Precipitation): به فرآیند تشکیل یک جامد از یک محلول گفته میشود. این فرآیند نیازمند شرایط خاصی از جمله تغییر حلالیت است.
- رسوبدهنده (Precipitant): ماده شیمیایی است که باعث تشکیل یک جامد در یک محلول مایع میشود. به عبارت دیگر، رسوبدهنده حلالیت ماده مورد نظر را کاهش میدهد و باعث رسوب آن میشود.
- رسوب (Precipitate): خود ماده جامدی است که در نتیجه فرآیند رسوبگذاری تشکیل میشود. رسوب میتواند اشکال مختلفی داشته باشد و اندازه ذرات آن متفاوت است.
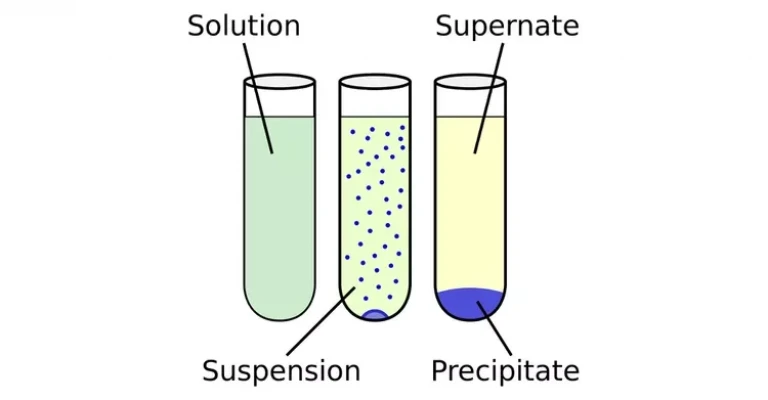
اگر اندازه ذرات ترکیب نامحلول بسیار کوچک باشد یا نیروی گرانش برای کشیدن جامد به پایین ظرف کافی نباشد، رسوب ممکن است به طور مساوی در سراسر مایع پخش شود و یک سوسپانسیون ایجاد کند.
تهنشینی (Sedimentation) به هر فرآیندی گفته میشود که رسوب را از قسمت مایع محلول جدا میکند، که به آن روآب (supernate) میگویند. یکی از روشهای رایج تهنشینی، سانتریفیوژ است. پس از بازیابی رسوب، پودر حاصل ممکن است "گل" نامیده شود.
مثالی از رسوب
مخلوط کردن نیترات نقره و سدیم کلرید در آب منجر به رسوب نقره کلرید به صورت جامد میشود. در این مثال، رسوب همان نقره کلرید است. این فرایند نشان دهنده کاهش حلالیت نقره کلرید در حضور سدیم کلرید است.
هنگام نوشتن یک واکنش شیمیایی، حضور یک رسوب ممکن است با قرار دادن یک پیکان رو به پایین بعد از فرمول شیمیایی نشان داده شود:
Ag+ + Cl- → AgCl↓
این علامت (↓) نشان می دهد که نقره کلرید (AgCl) به صورت رسوب از محلول جدا می شود و دیگر حلالیت ندارد.
کاربردهای رسوبات
رسوبات در زمینههای مختلفی کاربرد دارند، از جمله:
- شناسایی یونها: رسوبات میتوانند برای شناسایی کاتیون یا آنیون موجود در یک نمک به عنوان بخشی از آنالیز کیفی مورد استفاده قرار گیرند. به ویژه، فلزات واسطه شناخته شدهاند که بسته به هویت عنصری و حالت اکسیداسیون خود، رسوبات با رنگهای مختلف تشکیل میدهند. این تغییر رنگ به دلیل تفاوت در حلالیت ترکیبات فلزی مختلف است.
- تصفیه و جداسازی: واکنشهای رسوبی برای حذف نمکها از آب، جداسازی محصولات و تهیه رنگدانهها استفاده میشوند. با کنترل شرایط واکنش، میتوان بلورهای خالص رسوب تولید کرد. در این کاربرد نیز، کنترل حلالیت نقش اساسی دارد.
- تقویت آلیاژها: در متالورژی، رسوبگذاری برای تقویت آلیاژها استفاده میشود.
به طور کلی، کنترل حلالیت از طریق رسوبگذاری، ابزاری قدرتمند در شیمی و مهندسی مواد است.
روشهای بازیابی رسوب
برای بازیابی رسوب از محلول، روشهای مختلفی وجود دارد که در ادامه به آنها اشاره میکنیم:
- صافی کردن (Filtration): در این روش، محلول حاوی رسوب از یک صافی عبور داده میشود. به طور ایدهآل، رسوب روی صافی باقی میماند در حالی که مایع از آن عبور میکند. برای کمک به بازیابی، میتوان ظرف را شستشو داد و روی صافی ریخت. همیشه مقداری از رسوب از بین میرود که ممکن است ناشی از حل شدن در مایع، عبور از صافی یا چسبیدن به محیط صافی باشد. در این روش، حلالیت و اندازه ذرات رسوب اهمیت دارند.
- سانتریفیوژ (Centrifugation): در سانتریفیوژ، محلول به سرعت چرخانده میشود. برای اینکه این تکنیک کار کند، رسوب جامد باید چگالتر از مایع باشد. رسوب فشرده شده، که به آن پلت (pellet) میگویند، را میتوان با ریختن مایع جدا کرد. به طور معمول، تلفات در سانتریفیوژ نسبت به صافی کردن کمتر است. سانتریفیوژ به خوبی با اندازههای نمونه کوچک کار میکند. در این روش، اختلاف چگالی بین رسوب و محلول اهمیت دارد.
- دکانتاسیون (Decantation): در دکانتاسیون، لایه مایع از روی رسوب ریخته یا مکیده میشود. در برخی موارد، یک حلال اضافی برای جدا کردن محلول از رسوب اضافه میشود. دکانتاسیون ممکن است با کل محلول یا پس از سانتریفیوژ استفاده شود.
انتخاب روش مناسب برای بازیابی رسوب به عواملی مانند اندازه ذرات رسوب، چگالی، حلالیت و حجم محلول بستگی دارد.
رسوبگذاری کهنه یا هضم رسوب
فرآیندی به نام رسوبگذاری کهنه یا هضم رسوب زمانی رخ میدهد که به یک رسوب تازه اجازه داده شود در محلول خود باقی بماند. معمولاً دمای محلول افزایش مییابد. هضم میتواند ذرات بزرگتری با خلوص بالاتر تولید کند. فرآیندی که به این نتیجه منجر میشود، به عنوان رسیدن استوالد (Ostwald ripening) شناخته میشود. این فرآیند با تغییر حلالیت در دماهای مختلف مرتبط است.
در این فرآیند، ذرات کوچکتر رسوب حل میشوند و بر روی ذرات بزرگتر رسوب میکنند، در نتیجه اندازه ذرات افزایش و خلوص آنها بیشتر میشود. افزایش دما باعث افزایش حلالیت ذرات کوچکتر و تسهیل این انتقال ماده میشود.
- شیمی
- علم



