واکنش های اندوگرمیک و اگزوترمیک: تفاوت ها و مثال ها
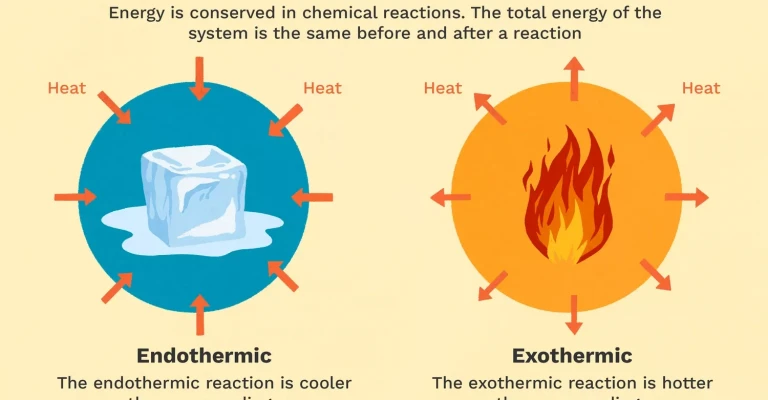
بسیاری از واکنش های شیمیایی برای انجام نیاز به جذب انرژی دارند. این واکنش ها، واکنش های اندوگرمیک نامیده می شوند. واکنش های اندوگرمیک نمی توانند به طور خودبخود انجام شوند و برای وقوع آنها باید کاری صورت گیرد. در این واکنش ها، با جذب انرژی کاهش دما در حین واکنش اندازه گیری می شود. واکنش های اندوگرمیک با جریان حرارت مثبت (به سوی واکنش) و افزایش آنتالپی (+ΔH) مشخص می شوند.
از سوی دیگر، سایر واکنش های شیمیایی انرژی را به شکل گرما، نور یا صدا آزاد می کنند. این واکنش ها، واکنش های اگزوترمیک به شمار می روند. واکنش های اگزوترمیک ممکن است به طور خودبخود انجام شوند و منجر به افزایش بی نظمی یا آنتروپی (ΔS > 0) در سیستم شوند. این واکنش ها با جریان حرارت منفی (گرما به محیط اطراف منتقل می شود) و کاهش آنتالپی (ΔH < 0) مشخص می شوند. در آزمایشگاه، واکنش های اگزوترمیک حرارت تولید می کنند و ممکن است حتی انفجاری باشند.
مثال هایی از فرآیندهای اندوگرمیک و اگزوترمیک
فتوسنتز مثالی از یک واکنش شیمیایی اندوگرمیک است. در این فرآیند، گیاهان از انرژی خورشید برای تبدیل دی اکسید کربن و آب به گلوکز و اکسیژن استفاده می کنند. این واکنش برای هر کیلوگرم گلوکز تولیدی به 15MJ انرژی (نور خورشید) نیاز دارد:
نور خورشید + 6CO2(g) + H2O(l) = C6H12O6(aq) + 6O2(g)
دیگر مثال های فرآیندهای اندوگرمیک شامل:
- حل شدن کلرید آمونیوم در آب
- شکستن آلکان ها
- سنتز هسته ای عناصر سنگین تر از نیکل در ستاره ها
- تبخیر آب مایع
- ذوب شدن یخ
یک مثال از یک واکنش اگزوترمیک، مخلوط کردن سدیم و کلر برای تولید نمک طعام است. این واکنش برای هر مول نمک تولیدی 411 kJ انرژی آزاد می کند:
Na(s) + 0.5Cl2(s) = NaCl(s)
دیگر مثال های فرآیندهای اگزوترمیک شامل:
- واکنش ترمیت
- واکنش خنثی سازی (مانند مخلوط کردن یک اسید و یک باز برای تشکیل نمک و آب)
- بیشتر واکنش های پلیمریزاسیون
- احتراق سوخت
- تنفس
- شکافت هسته ای
- خوردگی فلز (واکنش اکسیداسیون)
- حل کردن یک اسید در آب
نشان دادن هایی که می توانید انجام دهید
بسیاری از واکنش های اندوگرمیک و اگزوترمیک شامل مواد شیمیایی سمی، حرارت یا سرما شدید یا روش های دفع نامناسب هستند. یک مثال از یک واکنش اندوگرمیک ساده، حل کردن کلرید پتاسیم (که به عنوان جایگزین نمک فروخته می شود) در دست با آب است. یک مثال از یک واکنش اگزوترمیک سریع، حل کردن پودر شوینده لباس در دست با کمی آب است.
این نشان دادن های اندوگرمیک و اگزوترمیک ایمن و ساده هستند:
- واکنش های اگزوترمیک برای امتحان: با یکی از این نشان دادن های ساده واکنش اگزوترمیک، چیزها را گرم کنید.
- ایجاد یک واکنش اندوگرمیک: برخی از واکنش های اندوگرمیک آن قدر سرد می شوند که می توانند باعث یخ زدگی شوند. اینجا یک مثال از یک واکنش ایمن برای بچه هاست که بتوانند لمس کنند.
- چگونه یک واکنش شیمیایی اگزوترمیک ایجاد کنیم: برخی از واکنش های اگزوترمیک شعله تولید می کنند و به طور فوق العاده داغ می شوند (مانند واکنش ترمیت). اینجا یک واکنش اگزوترمیک ایمن است که حرارت تولید می کند اما آتش نمی زند یا سوختگی ایجاد نمی کند.
- ساخت یخ داغ از سرکه و جوش شیرین: شما می توانید از استات سدیم یا "یخ داغ" به عنوان یک واکنش اندوگرمیک یا اگزوترمیک استفاده کنید، بسته به اینکه آیا شما کریستال سازی می کنید یا ماده را ذوب می کنید.
مقایسه واکنش های اندوگرمیک و اگزوترمیک
در اینجا یک خلاصه سریع از تفاوت های بین واکنش های اندوگرمیک و اگزوترمیک آورده شده است:
واکنش های اندوگرمیک واکنش های اگزوترمیک
واکنش های اندرگونیک و اگزروگونیک
واکنش های اندوگرمیک و اگزوترمیک به جذب یا آزادسازی گرما اشاره دارند. انواع دیگر انرژی ممکن است توسط یک واکنش شیمیایی تولید یا جذب شوند (نمونه هایی از جمله نور و صدا). به طور کلی، واکنش های مرتبط با انرژی می توانند به عنوان واکنش های اندرگونیک یا اگزروگونیک طبقه بندی شوند. یک واکنش اندوگرمیک نمونه ای از یک واکنش اندرگونیک است. یک واکنش اگزوترمیک نمونه ای از یک واکنش اگزروگونیک است.
حقایق کلیدی
- واکنش های اندوگرمیک و اگزوترمیک واکنش های شیمیایی هستند که به ترتیب گرما را جذب و آزاد می کنند.
- فتوسنتز مثالی عالی از یک واکنش اندوگرمیک است. احتراق نمونه ای از یک واکنش اگزوترمیک است.
- طبقه بندی یک واکنش به عنوان اندوگرمیک یا اگزوترمیک به انتقال خالص گرما بستگی دارد. در هر واکنش خاص، گرما هم جذب و هم آزاد می شود. به عنوان مثال، برای شروع یک واکنش احتراق، انرژی باید وارد شود (مانند روشن کردن آتش با چوب کبریت)، اما سپس گرمای بیشتری نسبت به مقدار مورد نیاز آزاد می شود.