آستاتین (At): کمیابترین عنصر رادیواکتیو | خواص، کاربردها و حقایق
آستاتین (Astatine) با نماد At و عدد اتمی 85، یک عنصر رادیواکتیو است. این عنصر به عنوان کمیابترین عنصر طبیعی در پوسته زمین شناخته میشود، زیرا تنها از طریق واپاشی رادیواکتیو عناصر سنگینتر تولید میشود. آستاتین از نظر خواص، شباهتهایی به ید، همسایه سبکتر خود، دارد.
در حالی که آستاتین یک هالوژن (عنصر غیرفلزی) است، ویژگیهای فلزی بیشتری نسبت به سایر عناصر این گروه دارد و به احتمال زیاد رفتاری شبهفلزی یا حتی فلزی از خود نشان میدهد. با این حال، هنوز مقادیر کافی از این عنصر تولید نشده است تا ظاهر و رفتار آن به عنوان یک عنصر تودهای (bulk element) به طور کامل مشخص شود.
اطلاعات سریع درباره آستاتین
- نام عنصر: آستاتین
- نماد عنصر: At
- عدد اتمی: 85
- دستهبندی: هالوژن
- شکل ظاهری: فلز جامد (پیشبینی شده)
حقایق اساسی درباره آستاتین
- عدد اتمی: 85
- نماد شیمیایی: At
- وزن اتمی: 209.9871
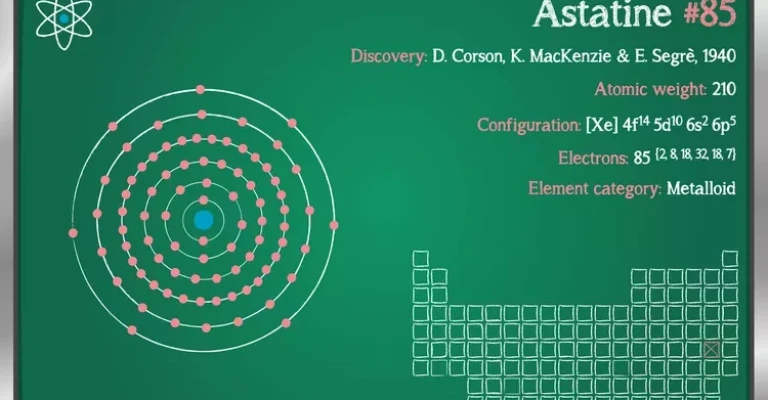
- کشف: در سال 1940 توسط D.R. Corson, K.R. MacKenzie و E. Segre در ایالات متحده کشف شد. دیمیتری مندلیف در سال 1869 در جدول تناوبی خود، فضایی را زیر ید خالی گذاشته بود و وجود آستاتین را پیشبینی کرده بود.
- آرایش الکترونی: [Xe] 6s2 4f14 5d10 6p5
- ریشه لغوی: از کلمه یونانی "astatos" به معنی ناپایدار گرفته شده است، که به واپاشی رادیواکتیو این عنصر اشاره دارد. نام آستاتین مانند سایر نامهای هالوژن، بازتابدهنده ویژگیهای عنصر است و با پسوند "-ین" ختم میشود.
- ایزوتوپها: آستاتین-210 با نیمهعمر 8.3 ساعت، پایدارترین ایزوتوپ شناخته شده است. در مجموع، 20 ایزوتوپ از آستاتین شناسایی شدهاند.
- خواص: آستاتین دارای نقطه ذوب 302 درجه سانتیگراد و نقطه جوش تخمینی 337 درجه سانتیگراد است. احتمالا دارای والانسهای 1، 3، 5 یا 7 است. آستاتین ویژگیهای مشترکی با سایر هالوژنها دارد و بیشتر شبیه به ید عمل میکند، با این تفاوت که خواص فلزی بیشتری از خود نشان میدهد. مولکولهای بینهالوژنی AtI، AtBr و AtCl شناخته شدهاند، اما هنوز مشخص نیست که آیا آستاتین مولکول دواتمی At2 را تشکیل میدهد یا خیر. ترکیبات HAt و CH3At شناسایی شدهاند. آستاتین احتمالاً قادر به تجمع در غده تیروئید انسان است.
- منابع: آستاتین برای اولین بار در سال 1940 توسط Corson، MacKenzie و Segre در دانشگاه کالیفرنیا با بمباران بیسموت با ذرات آلفا سنتز شد. آستاتین میتواند از طریق بمباران بیسموت با ذرات آلفای پرانرژی برای تولید At-209، At-210 و At-211 تولید شود. این ایزوتوپها را میتوان با حرارت دادن هدف در هوا تقطیر کرد. مقادیر کمی از At-215، At-218 و At-219 به طور طبیعی با ایزوتوپهای اورانیوم و توریم یافت میشوند. مقدار کل آستاتین موجود در پوسته زمین کمتر از 30 گرم است.
- کاربردها: مشابه ید، آستاتین میتواند به عنوان یک رادیوایزوتوپ در پزشکی هستهای، عمدتاً برای درمان سرطان، استفاده شود. مفیدترین ایزوتوپ احتمالاً آستاتین-211 است. اگرچه نیمهعمر آن تنها 7.2 ساعت است، اما میتوان از آن برای درمان هدفمند با ذرات آلفا استفاده کرد. آستاتین-210 پایدارتر است، اما به پولونیوم-210 خطرناک واپاشی میشود. در حیوانات، آستاتین (مانند ید) در غده تیروئید متمرکز میشود. علاوه بر این، این عنصر در ریهها، طحال و کبد نیز متمرکز میشود. استفاده از این عنصر بحثبرانگیز است، زیرا نشان داده شده است که باعث تغییرات بافت پستان در جوندگان میشود. در حالی که محققان میتوانند با خیال راحت مقادیر کمی از آستاتین را در هودهای بخار با تهویه مناسب، کار کنند، کار با این عنصر بسیار خطرناک است.
اطلاعات فیزیکی آستاتین
- دستهبندی عنصر: هالوژن
- نقطه ذوب (K): 575
- نقطه جوش (K): 610
- شکل ظاهری: احتمالاً فلز جامد
- شعاع کووالانسی (pm): (145)
- شعاع یونی: 62 (+7e)
- الکترونگاتیوی پائولینگ: 2.2
- انرژی یونیزاسیون اول (kJ/mol): 916.3
- حالتهای اکسیداسیون: 7, 5, 3, 1, -1
- جدول تناوبی
- شیمی
- علم



